虽然我们通常认为疾病是由异物——细菌或病毒——引起的,但实际上有数百种影响人类的疾病是由细胞产生蛋白质的错误引起的。
由马萨诸塞大学阿姆赫斯特分校(University of Massachusetts Amherst)领导的一组研究人员利用尖端技术的力量,包括一种名为糖蛋白组学的创新技术,解锁了基于碳水化合物的代码,该代码控制着某些类别的蛋白质如何形成保持我们健康所必需的复杂形状。
这项发表在《分子细胞》(Molecular Cell)杂志上的研究探索了一种名为蛇形蛋白的蛋白质家族的成员,这种蛋白质与许多疾病有关。这项研究首次调查了附着在蛇形蛋白上的碳水化合物的位置和组成如何确保它们正确折叠。
严重的疾病——从肺气肿、囊性纤维化到阿尔茨海默病——都可能在细胞对蛋白质折叠的监督出错时产生。识别负责高保真折叠和质量控制的糖密码可能是针对许多疾病的药物治疗的有希望的方法。
科学家们曾经认为,控制生命的唯一密码是DNA,而一切都取决于DNA的四个组成部分——a、C、G和t的组合和重组。但近几十年来,人们已经清楚地认识到,还有其他密码在起作用,尤其是在构建复杂折叠的分泌蛋白质时,这些蛋白质是在人类细胞的蛋白质工厂内质网(ER)中产生的,内质网是一个膜封闭的隔间,蛋白质折叠是从这里开始的。
大约7000种不同的蛋白质——占人体所有蛋白质的三分之一——在内质网中成熟。分泌的蛋白质——统称为“分泌组”——负责从我们身体的酶到免疫和消化系统的一切,必须正确形成人体才能正常运作。
被称为“伴侣”的特殊分子帮助蛋白质折叠成最终形状。它们还有助于识别折叠不完全正确的蛋白质,为它们重新折叠提供额外的帮助,或者,如果它们无可救药地折叠错误,在它们造成损害之前将其摧毁。然而,伴侣系统本身,它包括细胞质量控制部门的一部分,有时会失败,当它发生时,结果可能对我们的健康是灾难性的。
在急诊室中发现以碳水化合物为基础的伙伴系统,要归功于麻省大学阿默斯特分校生物化学和分子生物学教授丹尼尔·赫伯特(Daniel Hebert)的开创性工作,他是这篇论文的资深作者之一,他在20世纪90年代作为博士后发起了这项工作。
Hebert说:“我们现在拥有的工具,包括麻省大学阿默斯特应用生命科学研究所的糖蛋白组学和质谱法,使我们能够回答25年来一直没有解决的问题。”“这篇新论文的主要作者凯文·盖伊(Kevin Guay)正在做一些我刚开始时只能梦想的事情。”
在这些悬而未决的问题中,最紧迫的是:伴侣如何知道7000种不同的类折纸蛋白质何时被正确折叠?
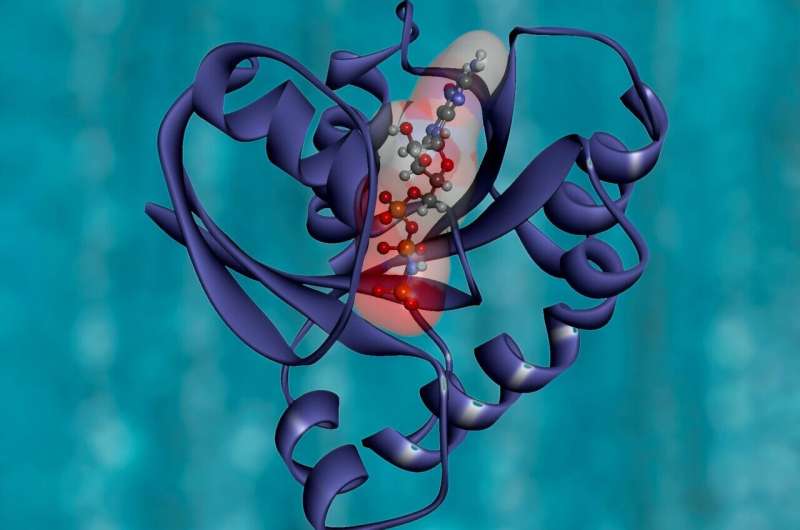
我们现在知道,答案涉及到一种被称为ugt的“内质网守门人”酶,以及一组被称为n -聚糖的碳水化合物标签,它们与蛋白质氨基酸序列中的特定位点相连。
Guay正在麻省大学阿姆赫斯特分校完成他的分子细胞生物学博士学位,他专注于研究两种特定的哺乳动物蛋白质,即α -1抗胰蛋白酶和抗凝血酶。
利用crispr编辑的细胞,他和他的合著者修改了内质网伴侣网络,以确定n -聚糖的存在和位置如何影响蛋白质折叠。
他们观察了疾病变异被内质网看门人ugt识别的过程,为了更密切地观察,他们开发了许多创新的糖蛋白组学技术,使用质谱法来了解蛋白质表面的聚糖发生了什么。
他们发现,ugt酶“标记”了错误折叠的蛋白质,糖被放置在特定位置。这是一种编码,监护人可以通过读取它来确定折叠过程到底在哪里出错以及如何修复。
盖伊说:“这是我们第一次能够看到ugt在人体细胞中制造的蛋白质上添加糖以进行质量控制。”“我们现在有了一个平台,可以扩展我们对糖标签如何将蛋白质发送到进一步的质量控制步骤的理解,我们的工作表明,ugt是靶向药物治疗研究的一个有前途的途径。”
马萨诸塞大学阿默斯特分校生物化学和分子生物学杰出教授、该论文的合著者之一莱拉·吉拉斯奇(Lila Gierasch)说:“这项研究令人兴奋的地方在于,我们发现了聚糖在内质网中充当蛋白质折叠的密码。”ugt所起作用的发现为未来理解和最终治疗数百种由错误折叠蛋白质引起的疾病打开了大门。”




